De siste par årene har et nytt verktøy innen genredigering “CRISPR” fanget allmennhetens oppmerksomhet og er mye omtalt i media. Nyheter om hvordan denne teknologien har blitt brukt til å "redigere" på arvestoffet (eller genmodifisere) hos mange organismer har kommet til oss. Metoden har et stort potensiale innen medisin og jordbruk.
Hva er CRISPR?
“CRISPR” er det alminnelige navnet for en molekylær bioteknologimetode.
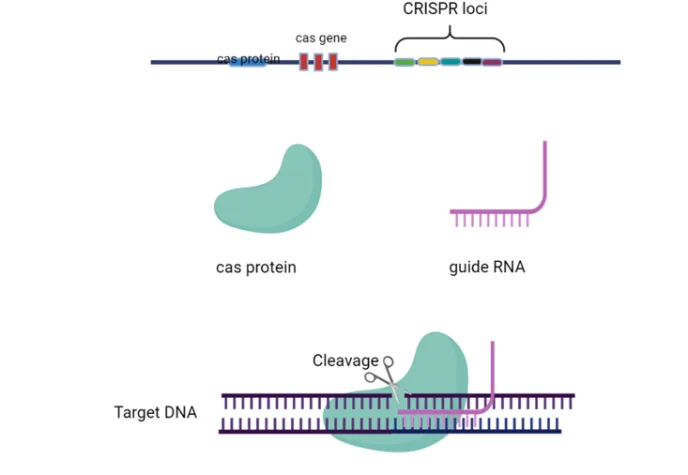
Ved en tilfeldighet ble CRISPR oppdaget i 2012 av to virusforskere. De oppdaget at bakterier hadde et effektivt forsvar mot virusangrep (ja, også bakterier kan infiseres av virus). Det forskerne fant var et protein som kunne klippe over virusets DNA-streng slik at det ikke kunne gjennomføre angrepet, altså en finurlig forsvarsreaksjon mot virus. Denne forsvarsreaksjonen er en genetisk mekanisme som gjør at bakterier kan gjenkjenne et invaderende virus og drepe det. Mekanismen blir styrt av en helt spesiell rekkefølge av gener (spesifikk genetisk sekvens) i bakterien. Denne sekvensen er kjent som “Clustered Regularly Interspaced Short Palendromic Repeats” (CRISPR). Det spesialiserte proteinet som kan klippe over virusets genstreng kalles “CRISPR-assosiert protein” (Cas) som det finnes flere varianter av. Vi kan beskrive det som en gensaks. CRISPR og gensaksa danner sammen dette forsvaret hos bakterier, og er definert som “CRISPR/Cas-systemet”, se figur 1. CRISPR har blitt det populære navnet på denne teknologien, og tillater presise og hårfine justeringer av veldig små deler av arvematerialet.
Kan vi bruke CRISPR til å produsere virusfri settepoteter?
Noe av det mest utfordrende i landbruket er produksjon av rent (virusfritt) plantemateriale. Rent utgangsmateriale er viktig for å kontrollere spredning av virussykdommer, spesielt i vegetativt formert planter, som for eksempel poteter. For å lage rent plantemateriale må morplanten være virusfri. Fjerning av virus fra planter er dessverre en veldig vanskelig og tidkrevende prosess, som involverer mange forskjellige teknikker (varmeterapi, kjemoterapi, meristemspisskultur, osv.). Med CRISPR/Cas13 ser vi en mulig måte å fjerne virus i planteceller, og metoden kan brukes til å lage virusfritt plantemateriale.
I samarbeid med Høgskolen i Innlandet, undersøker nå NIBIO mulige måter å bruke Cas13 (og også Cas9) som en metode for å lokalisere plantevirus inne i cellene og drepe dem. På denne måten kan vi lage virusfritt morplantemateriale, som videre kan brukes i storskalaproduksjon av rent plantemateriale. CRISPR/Cas13-teknologi har et større potensiale enn vi kan forestille oss med direkte anvendelse rettet mot plantehelse.
Hvordan fungerer CRISPR/Cas systemet?
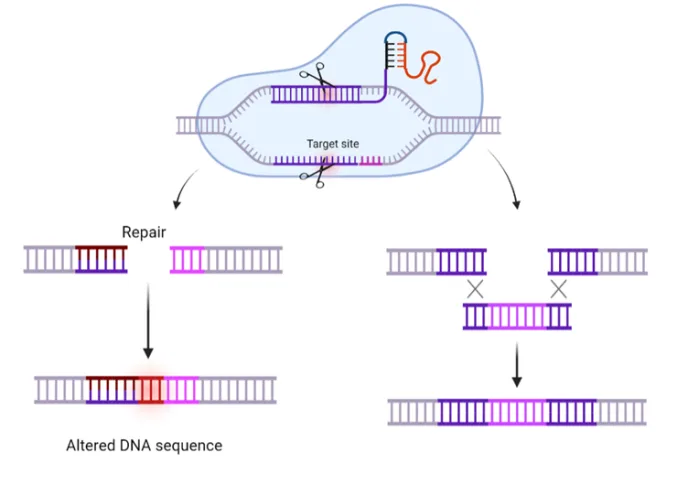
Da denne gensaksa ble oppdaget, fant forskere ut at dette, på grunn av sin enkle virkemåte, også kunne brukes på andre organismer. Kort fortalt, gensaksa gir oss mulighet for å søke etter bestemte genetiske sekvenser i en celle og redigere dem. Dette skjer ved å klippe opp og fjerne, legge til, eller bytte ut gensekvenser, noe som for eksempel kan resultere i at et gen ikke uttrykkes, eller at det kodede protein inneholder små eller større endringer, se figur 2.
To komponenter er viktig for at CRISPR/Cas skal fungere
- Gensaksa er et CRISPR-assosiert protein (Cas) som redigerer nukleinsyrer*.
- guide RNA (gRNA)-molekyl. gRNA er et spesielt RNA-molekyl som bestemmer hvilken del av genet saksa skal endre på. Hvis vi kjenner den genetiske sekvensen til genet vi vil redigere, kan vi dermed lage et bestemt gRNA som vil geleide Cas-proteinet til riktig DNA-sekvens hvor det skal binde seg til og kutte.
Det er mange forskjellige typer Cas-proteiner. Generelt blir de delt inn i proteiner som redigerer DNA eller RNA. Cas9 er det mest brukte proteinet for redigering av DNA, mens proteinet Cas13 blir brukt til å redigere RNA, se figur 3.
* nukleinsyre er biokjemiske forbindelser som styrer oppbyggingen av proteiner.

Når bruker vi CRISPR/Cas9 og når bruker vi CRISPR/Cas13?
Når vi snakker om "gener" generelt snakker vi om en genetisk sekvens (en del av et gen) som er sammensatt av DNA. Dermed er CRISPR/Cas9-systemet den gensaksa vi bruker for å redigere gener.
Et eksempel er modifisering av skallfarge med CRISPR/Cas9
Hvis vi for eksempel vil modifisere et gen som bestemmer fargen på potetskallet, vil vi bruke gensaksa med navn CRISPR/Cas9. Faktisk er 90 % av all bruk av CRISPR så langt basert på CRISPR/Cas9, og er den teknologien som er mest brukt innen bioteknologirelatert forskning.
Hvordan kan CRISPR/Cas13 brukes i planter?
Gensaksa CRISPR/Cas13 er mindre kjent, men er det som blir brukt til å redigere RNA. De fleste plantevirus er RNA-virus, og CRISPR/Cas13 er derfor det perfekte verktøyet for å bekjempe virus. Metoden kan brukes på mange måter.
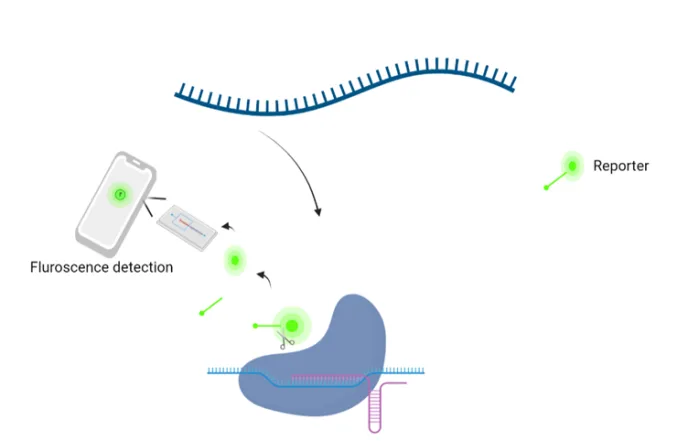
I 2018 ble det publisert en artikkel om en revolusjonerende metode som gjør det mulig å påvise menneskevirus ute i felt ved hjelp av CRISPR/Cas13, uten bruk av spesialutstyr (Myhrvold, Freije et al. 2018). Samme metode kan brukes til å påvise virus i planter. Kort fortalt bruker CRISPR-systemet et Cas13-protein (et guide-RNA) som kjenner igjen et spesifikt virus, i tillegg til et fluoriserende reportermolekyl*.
Det fungerer slik: Cas13-proteinet danner en kompleks forbindelse med guide-RNA. Deretter "jakter" denne forbindelsen på det spesifikke viruset vi ser etter. Så snart viruset er funnet, kutter gensaksa (Cas13-RNA-komplekset) viralt RNA og aktivere reportermolekylet, som deretter kan påvises ved fluorosens (eller utvikles til en lateral strømningstest). Det som er enda mer lovende er at denne testen er forbedret på en slik måte at en fluorosenspåvisning nå kan bli målt med en mobiltelefon (Fozouni, Son et al. 2021), se figur 4.
* Et reportermolekyl er et molekyl som når det blir aktivert gir et signal (for eksempel en farge). I en ELISA-test er substratet et reportermolekyl, og gir en gul-grønn farge på testen for eksempel viruset vi tester for er til stede.
Er det noen studier på CRISPR/Cas13 for planter i Norge?
Mesteparten av forskningen om CRISPR i Norge setter søkelys på CRISPR/Cas9. Med økonomisk bidrag fra Landbruksdirektoratet etablerte NIBIO i 2019 et samarbeid med eksperter innen CRISPR/Cas13-teknologien på menneskevirus. I tillegg startet NIBIO studier om hvordan det er mulig å bruke denne teknologien på plantevirus.
De to siste årene er det utviklet en prototype av CRISPR-basert metode for å påvise virus i planter. Metoden er en tilpasning av samme fremgangsmåte som blir brukt for å påvise virus hos mennesker. I laboratoriet på Ås har forskere hos NIBIO klart å påvise tre potetvirus (PVY (potetvirus Y), PVX (potetvirus X) og moptop (Potato moptop virus)) med denne metoden. Resultatene var like nøyaktige som ved bruk av standard PCR (polymerase chain reaction). Den nye metoden for påvising av virus kan oppdage viruset både i knollprøver og fra frossent plantemateriale, noe som indikerer at systemet er robust og også kan brukes under ugunstige forhold. Resultatene er så langt en bekreftelse på at teknikken er anvendelig på planter. NIBIO planlegger å fortsette forskningen i årene som kommer.
Målet vil være å utvikle en enkel og pålitelig påvisningsmetode som kan brukes i felt, i kombinasjon med en standard mobiltelefon. Som følge av enorme fremskritt innen påvisning av virus i forbindelse med behovet for pålitelige og raske metoder for påvisning av Covid-19-viruset tror forskerne at dette er et mulig mål. CRISPR/Cas13-metodene som ble utviklet av NIBIO sine samarbeidspartnere i USA blir nå brukt som en sertifisert metode for påvisning av Covid-19.
Før en kan bruke CRISPR-teknologien på planter er det behov for mer forskning, investering i utstyr, og standardisering og validering av metodene.
Finansiering
Prosjektet er finansiert av "Forskningsmidlene for jordbruk og matindustri (FFL/JA)", Landbruksdirektoratet.
Fakta om genmodifisering
Har du spørsmål om teknologien?
Har spørsmål og ønsker å vite mer om denne teknologien, eller har ideer om hvordan vi kan bruke den?
Ta kontakt med oss i NIBIO! Vi er ivrige etter å utvikle og markedsføre denne teknologien i planter.
Kontakt Carl Spetz hos NIBIO, eller Robert Wilson hos Høgskolen i Innlandet.
Kilder:
Fozouni, P., et al. (2021). "Amplification-free detection of SARS-CoV-2 with CRISPR-Cas13a and mobile phone microscopy." Cell 184(2): 323-333 e 329.
Myhrvold, C., et al. (2018). "Field-deployable viral diagnostics using CRISPR-Cas13." Science 360 (6387): 444-448.




